2.8. Отклонение реальных газов от идеального газа
Газовые законы справедливы только для идеального газа. В технических расчетах, связанных с реальными углеводородными газами, их применяют только в пределах давления до 0,2–,0 МПа (в зависимости от вида газа) и при температуре, превышающей 0С. При более высоком давлении или более низкой температуре либо применяют уравнения, учитывающие объем, занимаемый молекулами, и силы взаимодействия между ними, либо вводят в уравнения для идеального газа опытные поправочные коэффициенты —коэффициенты сжимаемости газа.
Уравнение состояния реального газа (уравнение Ван-дер-Ваальса) применяется наиболее часто:
(р + A/V2) (V–B) = RT
или для 1 моля газа
(р + A/V2) (V1 — B) = MRT
где А и B — константы, характерные для каждого газа; величина А/V2 отражает силы межмолекулярного взаимодействия, возрастающие с повышением давления до определенного предела; величина B — собственный объем, занимаемый молекулами газа.
Уравнение Ван-дер-Ваальса дает результаты, совпадающие о практическими данными, для газов с малой плотностью в широких диапазонах давлений и температур. Для тяжелых углеводородов (пропана, пропилена, н-бутана, бутилена и др.) могут возникнуть ошибки, достигающие 2–0% в зависимости от давлений и температур.
В практических расчетах применяются уравнения идеального газа с введением в них экспериментально определенных поправок на сжимаемость. При введении таких поправок приведенные выше уравнения принимают вид:
V = 0,3708Vн (T/р) Z и ρ = 2,6965ρн (p/T) (1/Z) и рV = RTZ
где Z —коэффициент сжимаемости —безразмерная величина; индекс н указывает на нормальные условия (0С и 101,3 кПа).
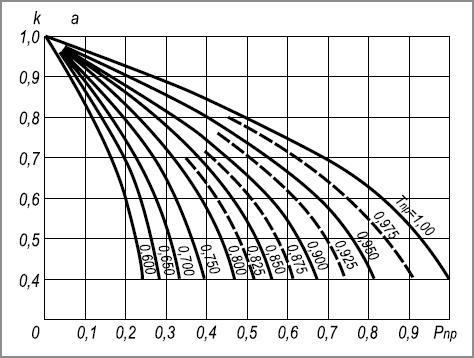
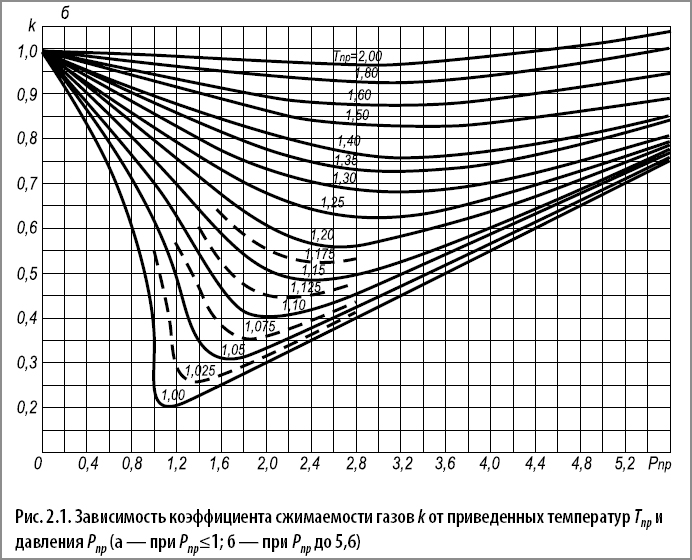
Так как экспериментальных данных по сжимаемости углеводородных газов недостаточно, то коэффициенты сжимаемости обычно определяются по графикам (рис. 2.1.), построенным по приведенным температурам и давлениям.
Для смесей газов пользуются средними критическими параметрами, определенными по составу газа:
pср.кр = Σripi кр
Тср.кр = ΣriТi кр
где r — молярная (объемная) доля компонентов, входящих в смесь; pi кр и Ti кр — критические давление и температура компонентов.