2.19. Внутренняя энергия, энтальпия, энтропия
На практике значение имеет не сама величина внутренней энергии, и ее изменение ΔU:
ΔU = cVM (t2 – t1) (2.62)
где сVM — средняя удельная массовая теплоемкость при постоянном объеме в пределах от t1 до t2 , кДж/(кг•°С). Таким образом, изменение внутренней энергии идеального газа равно произведению средней теплоемкости при постоянном объеме на разность температур газа.
Э н т а л ь п и я (теплосодержание насыщенного газа) — количество теплоты, необходимое для повышения температуры 1 кг вещества от аб солютного нуля до пара заданной температуры. В общем случае энталь пия является функцией температуры и давления. Как и в случае с внутренней энергией, чаще надо знать изменение эн тальпии ΔI, а не ее абсолютное значение:
ΔI = срМ (t2 – t1) (2.63)
где срМ — средняя удельная массовая темплоемкость при постоянном дав лении в пределах от t1 до t2, кДж/(кг.°С).
Следовательно, изменение энтальпии идеального газа равно произведе нию средней теплоемкости при постоянном давлении на разность темпе ратур газа.
Энтальпию реального газа можно рассматривать как сумму энтальпии в идеальном состоянии и соответствующего корректирующего члена:
I = Iид + ΔI (2.64)
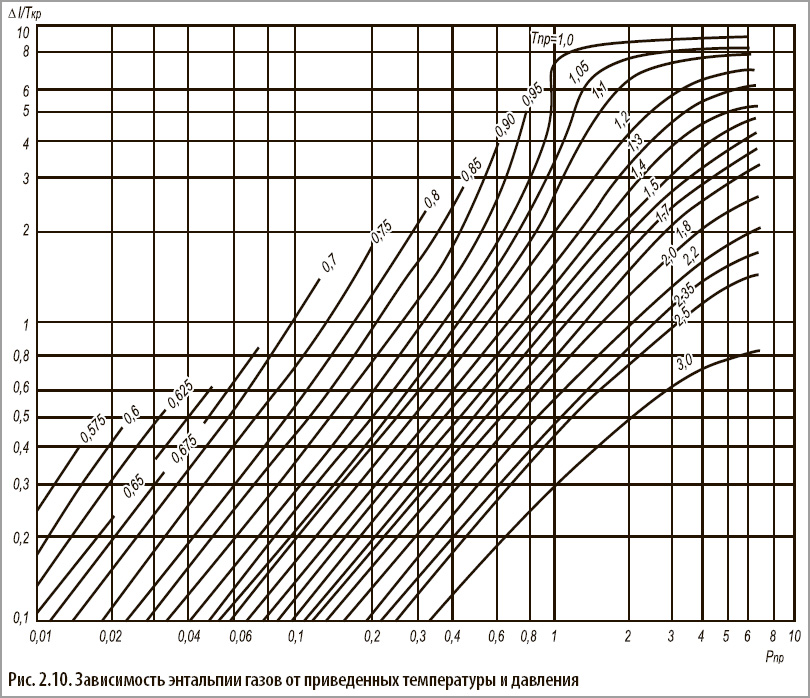
Корректирующий член ΔI может быть определен по графику зависимо сти энтальпии газов от приведенных температуры и давления.
Э н т р о п и я, так же как энтальпия и внутренняя энергия, — функция состояния рабочего тела (системы). Элементарное приращение энтропии в любом обратимом процессе выражается соотношением
dS = dQ/T = (dU + Adl)/T (2.65)
где dS — приращение энтропии, кДж/(кг•К); dQ — изменение тепловой энергии рабочего тела, кДж/кг; dU — приращение внутренней энергии, кДж/кг; dl — внешняя работа, кДж/кг; А—тепловой эквивалент работы, равный 1/101,7 кДж (кг•м); Т — абсолютная температура, К.
В практике расчет энтропии встречается редко, поэтому в данном слу чае имеет смысл обратиться к специализированной литературе.